Organização da Tabela: muitas propriedade físicas e químicas dos elementos variam periodicamente na sequência de seus números atômicos.
18 grupos ou famílias - verticais
Valência:
1A - 1
2A - 2
3A- 3
4A - 4
5A- 3
6A- 2
7A - 1
8A - 0
Classificação:
Metais: são os maiores condutores de eletricidade e calor da natureza. Estão em maioria na tabela periódica dos elementos. São sólidos, flexíveis e maleáveis, com exceção do mercúrio.
Ex:Titânio (Ti); Cromo (Cr); Ferro (Fe); Níquel (Ni); Cobre (Cu); Paládio (Pd) e Zinco (Zn).
Ametais: ao contrário dois metais, estes elementos são os que existem em maior quantidade na natureza. Eles não tem brilho, não são flexíveis nem são bons condutores de calor e eletricidade com os metais.
Ex: Oxigênio (O); Flúor (F); Nitrogênio (N)...
Gases Nobres: a característica mais importante é a inércia química, ou seja, eles tem a propriedade de não reagir em contato com outra substancia. São seis: hélio, neônio, argônio, criptônio, xenônio e radônio.
Hidrogênio: é classificado à parte porque não se comporta como nenhum dos outros elementos.
Representativos, transição interna e transição externa:
Para saber a família, o período, a classificação e se o elemento é representativo, de transição ou de transição externa:
Ex¹: Li 3 ---> 1s² 2s¹
família 1A
Ex²: Ca 20 ---> 1s², 2s², 2p6, 3s², 3p6, 4s²
família 2A
Família 5A - P15= 1s²/ K, 2s² 2p6/L, 3s² 3p³ = 5é
família 6A - O8 = 1s²/ K, 2s² 2p4/L = 6é
Família 7A - Cl 17 = 1s²/ K, 2s² 2p6/L, 3s² 3p5 = 7é
Ex³: As (Z= 85)
1s² 2s² 2p6 3s² 3p6 4s² 3d10 4p6 5s² 4d10 5p6 6s² 4f14 5d10 6p5
1s²/ K, 2s² 2p6/ L, 3s² 3p6 3d10/ M, 4s² 4p6 4d10 4f14/ N, 5s² 5p6 5d10/ O, 6s² 6p5/P = 7é
6º período (termina em 6)
Família: 7A
Classificação: p (terminou no p)
Representativo, pois:
s ou p = representativo
d = transição
f = transição externa
Propriedades Periódicas
Raio atômico:
É a metade da distância entre o centro de átomos vizinhos em uma amostra do gás sólido. žOs raios atômicos geralmente decrescem da esquerda para direita em cada período devido ao aumento do número atômico efetivo, e crescente em cada grupo quando camadas sucessivas estão ocupadas pelos elétrons.
Energia de Ionização:
É a energia necessária para remover um ou mais elétrons de um átomo isolado no estado gasoso. žA primeira
energia de ionização é maior para os elementos próximos do hélio e menor para
os próximos do césio. A segunda energia de ionização é maior do que a primeira
(do mesmo elemento) e a diferença é muito maior se o segundo elétron for
retirado de uma nível de energia fechado. Os metais são encontrados na parte inferior, à
esquerda, da Tabela Periódica porque esses elementos tem baixa energia de
ionização e podem perder elétrons facilmente.
Afinidade Eletrônica:
É a energia liberada quando um átomo isolado, no estado gasoso, "captura" um elétron. Os elementos
dos grupos 16/VI e 17/VII tem afinidades eletrônicas mais altas.
Baixe o exercício!! http://www.4shared.com/file/lMP0TCU4/Distribuio_eletronica_tabela_p.html
Postagens: números quânticos, distribuição eletrônica, tabela periódica.
Vídeo!



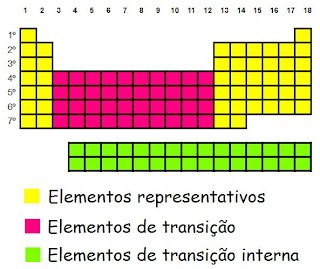



Quando que a família será B?
ResponderExcluirObservando a tabela períodica, os elemento da família B são os que se encontram no centro (em rosa). Os elementos da familia B são elemento de transição. Então a família do elemento vai ser B, quando ele for um elemento classificado como sendo de transição, assim como os elementos da família A são classificados como representativos.
ResponderExcluirMeu Professor pediu um trabalho sobre as duas principais tabelas periodicas... quais seriam essas??
ResponderExcluirTem a tabela periódica Normal (a que conhecemos) e uma mais recente, a Galáxia Quimica.
Excluirme passa o composto do carbono por favor
ResponderExcluiragradecida .camila
O carbono é um elemento químico de número atômico 6 e massa atômica 12,01. É classificado na tabela periódica como representativo e é um não metal.
Excluir