O
que se entende por solução?
Em
casa, quando preparamos um suco em um dia de muito calor, estamos preparando
uma solução. A água é o solvente (substância capaz de dissolver outra), onde
vamos dissolver o açúcar e o suco em pó (os solutos, substâncias que são
dissolvidas em um solvente). Dessa mistura temos uma solução!
No
laboratório também é assim. Veja o esquema:
Um químico que deseja preparar uma solução
precisa saber qual a massa que deve usar a depender do volume e a concentração
que existe do soluto na solução. Mas antes de começarmos a entender sobre as
concentrações de soluções aquosas, é impostante saber diferenciar os tipo de
soluções. As soluções são classificadas a partir de dois parâmetros: condução
de corrente elétrica e estado físico.
1. Quanto a condução de corrente elétrica:
Uma
solução que não conduz corrente elétrica é chamada de solução não eletrolítica. Como não há íons livres e as partículas
do soluto são moléculas, não há condução de eletricidade:
A
solução aquosa de etanol não conduz corrente elétrica.
Uma
solução eletrolítica conduz corrente
elétrica devido à presença de íons livres, causada pela ionização ou
dissociação iônica do soluto, que é um eletrolítico:
A
solução aquosa de NaCl conduz corrente elétrica.
2. Quanto ao estado físico:
As soluções podem ser classificadas como
sólidas, líquidas ou gasosas. O ouro 18 quilates (75% Au e 25% Cu) é uma
solução sólida. O ar que respiramos é uma mistura homogênea de diversos gases,
entre eles nitrogênio, oxigênio e argônio, portanto, é uma solução gasosa. Ao
se dissolver hidróxido de sódio em água, tem-se uma solução líquida.
Agora
que já aprendemos o que são as soluções, vamos aprender a expressar as
concentrações das soluções aquosas.
1. Concentração Comum: é utilizada para expressar a
concentração de uma solução por meio da massa
do soluto dissolvido em certo volume
de solução.
Ex: seja 150 g de NaOH (hidróxido de sódio) dissolvido em 200 ml de solução. Encontre a concentração comum.
V= 200 ml = 0,2 litros
m1 = 150 g (NaOH)
C= 150/ 0,2 = 750 g/l
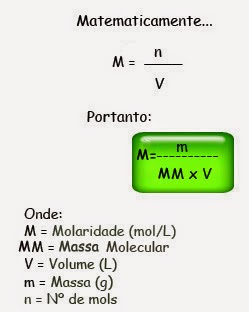
Exemplo: qual é a concentração molar de
uma solução com volume de 250 mL que contém 55,5 g de cloreto de cálcio (CaCl2)?
M=?
m = 55,5 g
V= 250 mL = 0,25 L
MM do CaCl2 = 111
g/mol
Então,
M= m/MM.V
M= 55,5/111.0,25
M=
2 mol/L
3- Título: é a relação entre quantidade de soluto e a quantidade
de solução.
Ex: dado 240g de NaCl, sendo dissolvido em 570g de água encontre o título comum e o título percentual.
Dados: m1 = 240g, m2 = 570g e m = m1 + m2= 810g
T= m1/m = 240/ 810 = 0,29
%t = T. 100 = 0,29 x 100 = 29%
Diluição
de Soluções
Quando você está preparando um
suco, a primeira coisa a se fazer é dissolver o suco em pó na água. Mas, e se você colocar suco em pó demais?
Provavelmente você irá colocar um pouco mais de água. Dessa forma você estará diluindo uma solução.
Em um laboratório de química não
existem soluções de todas as concentrações possíveis e inimagináveis.
Geralmente são preparadas e armazenadas soluções de concentrações elevadas e, a
partir delas podem-se obter outras mais diluídas (isto é, menos concentradas),
por meio da diluição.
Os
cálculos de diluição:
Como na diluição, a quantidade do
soluto não se altera, podemos afirmar que a quantidade de matéria (n) de soluto
existente ma alíquota está também presente na nova solução obtida pela diluição
da alíquota. Usando índice i para
alíquota inicial e f para alíquota
final, temos:
ni soluto = nf soluto:
mi.Vi
= mf.Vf
mi soluto = mf soluto:
CiVi
= Cf.Vf
mi soluto = mf soluto
Ti.mi
= Tf.mf
Ao se diluir uma solução, a
quantidade de soluto dissolvida não se altera, porém o volume total da solução
aumenta e a massa total da solução também aumenta.
Exemplo
1: (Uninove-SP)
Em um frasco há uma solução aquosa de H2SO4 com
concentração inicial Ci = 196 g/L. O volume de 0,5 L dessa solução
foi transferido para um béquer, e foi diluída acrescentando-se 1,5 L de água
pura. Qual será a concentração final da
solução?
Ci = 196 g/L
Vi = 0,5 L
Adicionando mais 1,5 L de água:
Cf = ?
Vf= 2,0 L
Portanto:
CiVi = Cf.Vf
196.0,5 = Cf.2,0
Cf
= 49 g/mol
Exemplo
2: (Mackenzie-SP)
Aquecem-se 800 mL de solução 0,02 mol/L de fosfato de sódio, até que o volume
de solução seja reduzido de 600 mL. A concentração molar da solução final é:
mi= 0,02 mol/L
Vf= 800 mL = 0,8 L
Após a redução de 600 mL de água:
mf=?
Vf= 200 mL = 0,2 L
Portanto:
mi.Vi = mf.Vf
0,02.0,8 = mf.0,2
mf=
8x10-2 mol/L
Misturas de
soluções de mesmo soluto e mesmo solvente
Duas
soluções aquosas de ácido sulfúrico, A e B, de concentração em gramas por litro
e concentração em quantidade de matéria conhecidas, serão misturadas conforme o
esquema a seguir:
Estamos
diante de uma situação em que soluções de mesmo soluto e mesmo solvente estão
sendo misturadas e necessitamos calcular a concentração da solução resultante.
Para isso, é fundamental que tenhamos um ponto de partida para os nossos
cálculos. Nesse caso, nos orientamos segundo o raciocínio: quando misturamos
soluções aquosas de mesmo soluto, a quantidade de soluto na solução final é
igual a soma das quantidades dos solutos nas soluções iniciais. Dessa forma:
m soluto final = m soluto
A + m soluto B ou Cf.Vf = CA.VA
+ CB.VB
n soluto final = n soluto
A + n soluto B ou mf.Vf
= mA.VA + mB.VB
Resolvendo
o problema proposta acima:
m
soluto final = m soluto A + m soluto B
Cf.Vf
= CA.VA + CB.VB
Cf.
3,0 = 196.1,0 + 98.2,0
Cf =
130,67 g/L
e
n
soluto final = n soluto A + n soluto B
mf.Vf = mA.VA + mB.VB
mf. 3,0 = 2,0.1,0 + 1,0.2,0
mf
= 1,33 mol/L
Baixe o exercício aqui: http://www.4shared.com/file/F6qVjTM_ce/Exerccios_de_Solues.html
Assuntos: soluções, relação entre concentrações, diluição de concentrações, mistura de soluções.
Vídeos:
Concentração de Soluções
Como é feita a diluição de uma solução?
Mistura de Soluções










orbelOmyo_ni1980 Jennifer Moravits download
ResponderExcluirclick
https://colab.research.google.com/drive/1OW494bP-O6GBnEWC7GwX1A_-wn0EZ7oo
click
phantiodwarkeo
profti0pau-ke1988 Darrell Oakland software
ResponderExcluirdownload
Awesome
cioglycarston